薬事関連サービス
CMC~非臨床~臨床~申請までのあらゆるお困り事をサポートいたします!
|
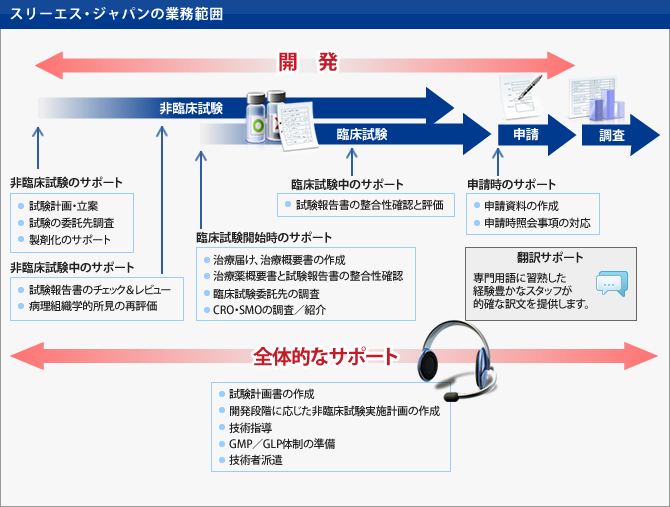
アールピーエムは、CMC・非臨床・臨床の各分野の専門家が医薬品開発における人材不足をサポートいたします。開発を進めている対象薬剤、医療機器について、CMCから非臨床(薬理・薬物動態・毒性)および臨床までの全般について、治験または申請業務終了までを専門家の立場でサポートします。 |
 |
■業務内容
◆導入剤、新規開発剤の開発申請戦略に関する各種相談
◆海外承認資料および試験報告書の評価(CMC・非臨床)
◆申請時の照会事項の対応
◆社内資料のレビュー
◆各種申請書作成支援及びコンサルティング業務(医療機器、体外診断薬、医薬部外品、再生医療製品)
• 製造販売承認申請関連業務:新規、一部変更、製造販売届、軽微変更届
• 業許可関連業務:業許可(新規 / 更新)申請、製造所登録(新規 / 更新 / 変更)申請
• QMS / GQP / GVP 体制構築・手順書作成
• 製品標準書 / 品質標準書作成
• GMP / QMS査察
• QMS適合性調査
• 上記コンサルティング業務
◆各種専門機関との打合せ及びコンサルティング業務
• 各種規格(ISO / IEC / JIS)に基づく試験施設の紹介及び試験手配
• 行政機関等(厚生労働省、医薬品医療機器総合機構、東京都庁、認証機関)との相談
• 上記コンサルティング業務
◆臨床試験実施支援及びコンサルティング業務(医療機器、体外診断薬)
• 臨床医との打合せ及び医薬品医療機器総合機構との事前面談・対面助言
• GCP必須文書の構築(プロトコル作成を含む)
• 医療機関IRB対応
• 臨床試験のプロジェクトマネジメント
• DM、QC、モニタリング、統計解析及び総括報告書の作成
◆海外上市支援及びコンサルティング業務
• CE marking
• PMA
• 510k
|
|
海外からの日本申請
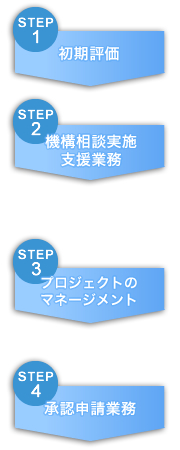 |
■クライアントからのデータに基づいて、開発候補品の初期評価を実施し、クライアントに提案。
■クライアントとの間で開発戦略を確認後、専門家との意見交換を開始
■クライアントのニーズに合わせ、相談機構相談及びその後のプロセスを支援または全面的にリード ■クライアントと一緒に機構相談を実施。日本における開発プラント確定 ■専門家によりプロトコール、治験届けの準備及び提出
■臨床試験実施のため、クライアントにとっての最適なCROをクライアントと一緒に選定 ■日本での開発業務を一部、または全体的に管理・監査 ■承認申請資料の作成
■機構からの照会事項に対し、回答書の作成を含めてクライアントを全面的にサポート |
| サービス内容に関するお問い合わせは、こちらより承ります。 |

